我們的服務
概覽
根據國家藥監局要求,醫療器械申請注冊證需按照風險等級進行分類。低風險的Ⅰ類醫療器械需要申請備案,高風險的Ⅱ、Ⅲ類醫療器械需要按照國家藥監局要求進行注冊,同時還需進行臨床評估,是否需要進行臨床試驗則視具體情況而定。
-一類醫療器械備案
-二、三類醫療器械首次注冊
-二、三類醫療器械延續注冊
-二、三類醫療器械證書注冊變更
-注冊文件準備與審核
-技術要求起草支持
-產品測試
-內審咨詢協助和指導
-補充材料準備指導
-臨床評價策略支持
概覽
為了在醫療器械注冊過程中和注冊后滿足國家藥監局的合規要求,醫療器械制造商應當對政府檢查(如飛行檢查、內部系統審計等)做出合規性承諾。
-醫療器械注冊初期的現場檢查提前模擬評估
-制造商取得目標醫療器械市場許可后的突擊模擬檢查
-內部系統審計的咨詢協助與指導
概覽
根據GMP / GSP要求,企業應當結合產品特性建立和完善與生產、經營醫療器械相匹配的質量管理制度,確保質量管理體系有效運行。為避免醫療器械質量風險,企業應建立以硬件為基礎、文件體系為支撐以及專業人員為保障的質量管理制度,生產質量合規的醫療器械產品。
-醫療器械潔凈廠房設施的建立與驗證
-醫療產品設計與開發流程咨詢服務
-質量管理體系文件的編制和改進咨詢服務
-常用設備驗證咨詢輔導
-設備驗證及特殊過程咨詢服務
-硬件質量體系合規審核支持
-建立和執行質量體系的培訓支持
-支持質量體系評估材料的準備與提交,直至評估通過并成功獲得評估報告
概覽
MAH注冊人制度,即國內醫療器械注冊上市許可持有人。除擁有生產許可的醫療器械制造商外,注冊人制度為獨立醫療機構和醫療器械科研人員在不符合先前要求的持有生產許可的強制性資格的情況下申請上市許可證書提供了合規性。 MAH旨在將營銷許可和制造許可解綁,通過讓更多研發驅動的醫療機構和沒有制造能力的人員加速中國國內的醫療器械創新,使患者受益,使醫療器械研究人員和制造商分別專注于各自的領域。 生產企業按照注冊人的委托要求生產,注冊人對醫療器械的研發、臨床試驗、制造、營銷和分銷等醫療器械的全質量生命周期負責。
-針對質量體系和風險體系,在注冊過程中為注冊人提供專業的多維度協助
-及時向客戶通報更新不同地區注冊人制度的最新規定
-協助為注冊人匹配合適的制造商
-注冊人規劃,及雙邊研發和制造商的對接溝通
-模擬GMP檢查以進一步確保審核成功
-為精選供應商提供可靠服務,從委托制造商到產品測試
概覽
MAH注冊人制度,即國內醫療器械注冊上市許可持有人。除擁有生產許可的醫療器械制造商外,注冊人制度為獨立醫療機構和醫療器械科研人員在不符合先前要求的持有生產許可的強制性資格的情況下申請上市許可證書提供了合規性。 MAH旨在將營銷許可和制造許可解綁,通過讓更多研發驅動的醫療機構和沒有制造能力的人員加速中國國內的醫療器械創新,使患者受益,使醫療器械研究人員和制造商分別專注于各自的領域。 生產企業按照注冊人的委托要求生產,注冊人對醫療器械的研發、臨床試驗、制造、營銷和分銷等醫療器械的全質量生命周期負責。
-文件準備
-現場評估
-受理前申請材料審核
-企業整改咨詢服務
-獲批后通知
概覽
隨著中國醫療器械審查制度不斷完善和醫療行業高速發展,大量創新型醫療器械正在被引入中國,越來越多國際醫療器械制造商開始將業務的戰略重心逐步轉向中國市場。而對希望進入中國市場的國際醫療器械制造商而言,在中國指定一位可信賴的代理商是滿足中國法律法規要求的必經之路。 擁有超過30年歷史的Chindex美中互利在醫療器械行業享有盛譽,一直致力于幫助國際醫療器械制造商加強在中國市場的的政策、監管協同,是國際醫療器械企業布局中國市場、開拓中國業務道路上值得信賴的合作伙伴。
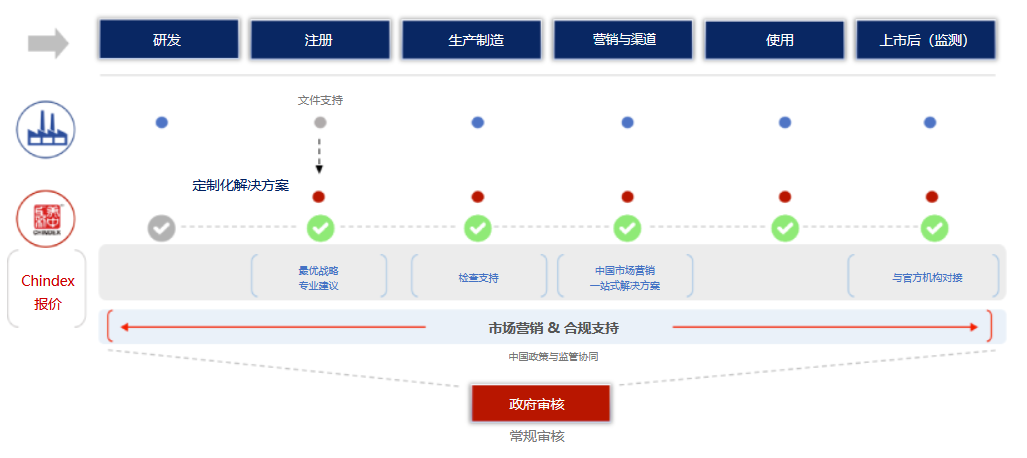
很遺憾,除非制造商在中國設有具有資質的分支機構來處理注冊問題,否則這是不合法的且不合規的,進而,海外制造商必須指定中國代理人進行醫療器械注冊。
對于NMPA注冊費,進口醫療器械第二類醫療器械注冊費為21.09萬元,第三類醫療器械注冊費為30.88萬元。此外,還應考慮其他可能的費用,例如文件翻譯費、臨床試驗費等。
注冊材料經國家藥監局受理后,第二類醫療器械技術審評需要60個工作日,第三類醫療器械技術審評需要90個工作日。國家藥監局要求補充材料的,生產企業有義務在一年內提交,否則可能終止評審。
有 CE 或 FDA 證書的醫療器械可以在沒有 NMPA 注冊證的情況下進入特別行政區。對于大灣區和海南省作為試點地區,在香港或澳門已上市的醫療器械,經當地政府批準,試點地區定點醫療機構愿意采購臨床急需醫療器械的,可進入試點地區。
京ICP備11010059號-1  京公網安備11010502035116號 (京)網藥械信息備字(2023)第 00034 號 版權所有©美中互利(北京)國際貿易有限公司
京公網安備11010502035116號 (京)網藥械信息備字(2023)第 00034 號 版權所有©美中互利(北京)國際貿易有限公司
京公網安備11010502035116號